Việt Nam sẽ sản xuất thuốc trị COVID-19?
[ad_1]
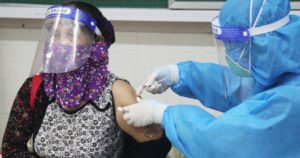
Sản xuất thuốc viên điều trị COVID-19 của Pfizer tại Freigburg, Đức trong tháng 11-2021 – Ảnh: PfizerTheo báo New York Times, việc Pfizer công bố thỏa thuận tương tự Hãng dược Mỹ Merck & Co tháng trước sẽ đưa đến khả năng mở rộng việc sản xuất hai loại thuốc trị COVID-19 trên toàn cầu. Ông James Love – người đứng đầu Tổ chức phi lợi nhuận Knowledge Ecology International – bình luận: “Việc chúng ta có giấy phép sản xuất hai loại thuốc này ở bất cứ đâu là một sự thay đổi lớn, và tương phản với sự hạn chế trong cấp phép sản xuất vắc xin COVID-19 tính đến nay”.Thuốc giá rẻ cho hơn 50% dân số thế giớiTheo thỏa thuận, Pfizer cấp quyền sản xuất thuốc generic (thuốc mang tên gốc để phân biệt với thuốc phát minh – thuốc gốc) của thuốc trị COVID-19 của hãng cho Tổ chức Sáng chế thuốc (MPP) để tổ chức do Liên Hiệp Quốc hậu thuẫn này cấp phép cho những nhà sản xuất thuốc generic đủ điều kiện tại 95 nước, hầu hết là tại châu Phi và châu Á, trong đó có Việt Nam.Trong khi đó, Pfizer sẽ bán thuốc trị COVID-19 với tên gọi Paxlovid tại các nước giàu. Thuốc generic là thuốc tương đương sinh học với biệt dược có thành phần hoạt chất tương tự nhau, thường được sản xuất khi biệt dược hết hạn bản quyền nên giá rẻ. Ông Charles Gore – giám đốc điều hành MPP – cho biết hơn 20 công ty đã liên hệ với MPP liên quan tới giấy phép của Pfizer, và việc sản xuất thuốc generic này có thể bắt đầu trong quý 1-2022.Trước đó, Hãng Merck và MPP cũng đạt thỏa thuận cho phép 105 nước thu nhập thấp và trung bình, chủ yếu ở châu Phi và châu Á, được phép sản xuất phiên bản generic của thuốc trị COVID-19 Molnupiravir của hãng.Trước thỏa thuận với MPP, Merck đã cấp phép cho 8 nhà sản xuất thuốc lớn của Ấn Độ để sản xuất thuốc generic của Molnupiravir. Merck cũng cam kết hỗ trợ chuyển giao công nghệ cho bất cứ hãng sản xuất thuốc nào yêu cầu giúp đỡ để sản xuất phiên bản generic của Molnupiravir.Theo nghiên cứu, Molnupiravir uống ngày 2 lần trong một liệu trình 5 ngày, trong khi Paxlovid uống 30 viên trong một liệu trình 5 ngày. Các dữ liệu từ thử nghiệm lâm sàng cho thấy Paxlovid giảm 89%, trong khi Molnupiravir giảm gần 50% nguy cơ nhập viện và tử vong nếu bệnh nhân dùng thuốc đủ sớm.Tuy nhiên, việc tiếp cận giấy phép của Pfizer cũng sẽ phụ thuộc vào tốc độ phê duyệt loại thuốc này của cơ quan y tế các nước và Tổ chức Y tế thế giới (WHO). Tại Mỹ, Pfizer cho biết đã hoàn tất việc nộp đơn xin cấp phép khẩn cấp Paxlovid, trong khi Molnupiravir dự kiến sẽ được phê duyệt trong vài tuần tới.Đội ngũ y tế trao thuốc cho bệnh nhân F0 tại nhà trên địa bàn TP.HCM – Ảnh: TỰ TRUNGThách thức sản xuất, giá cả ra sao?Ông Stephen Saad – giám đốc điều hành Hãng dược Aspen Pharmacare ở Nam Phi – cho biết công ty ông sẽ xin MPP cấp phép để sản xuất thuốc generic của Paxlovid, và dự kiến bán với giá khoảng 10 USD/liệu trình tại châu Phi dù hiện tại ông Saad không thể nói trước về việc khi nào Aspen mới có thể sản xuất thuốc generic của Paxlovid do công ty chưa biết gì về công nghệ sản xuất hay những nguồn cung cấp nguyên liệu thô nào của thuốc là sẵn có.Ngày 16-11, nhà sản xuất thuốc generic Dr. Reddy’s Laboratories (Ấn Độ) – đã đăng ký sản xuất thuốc generic của Molnupiravir – cho biết họ cũng sẽ sản xuất thuốc generic của Paxlovid, theo trang web Fierce Pharma. Theo New York Times, các nhà sản xuất thuốc generic tại các nước đang phát triển dự kiến tiếp thị thuốc generic của Molnupiravir với giá 20 USD/liệu trình, so với thỏa thuận 712 USD/liệu trình của Merck với Chính phủ Mỹ.Trong khi đó, ông Gore cho biết một số người trong lĩnh vực sản xuất thuốc generic nói với ông rằng thuốc generic của Molnupiravir có thể được sản xuất có lời với giá khoảng 8 USD/liệu trình.Có thuốc chữa vẫn phải phòngBáo Washington Post dẫn lời bà Ellen ‘t Hoen – giám đốc Tổ chức nghiên cứu Medicines Law & Policy và là thành viên nhóm cố vấn của MPP – cho biết thuốc viên trị COVID-19 là một bước quan trọng góp phần giải quyết đại dịch COVID-19 nhưng không thể thay thế vắc xin. “Sau tất cả, phòng bệnh vẫn hơn chữa bệnh” – bà Hoen nói.Cấp phép sản xuất và bán thuốc của Pfizer thế nào?Các nhân viên của Pfizer trao đổi trong một phòng làm việc của công ty – Ảnh: PfizerLoại thuốc kháng virus của Pfizer có tên PF-07321332, dùng kết hợp với thuốc Ritonavir liều thấp. MPP đã mời các bên từ bất kỳ nơi đâu trên thế giới gửi thư bày tỏ nguyện vọng (EOL) xin cấp “giấy phép con” (sublicense) để sản xuất và bán thuốc PF-07321332 cùng với Ritonavir. Cụ thể với các quy định:Điều kiện để cấp giấy phép con: có thể cấp cho bất kỳ thực thể đủ điều kiện nào trên toàn thế giới.Sản xuất: cho phép sản xuất thành phần dược hoạt tính và các công thức thành phẩm của thuốc PF-07321332 ở bất kỳ đâu trên thế giới.Phạm vi bán: cho phép bán PF-07321332 tại 95 quốc gia.Vấn đề bán bên ngoài lãnh thổ được cấp phép: không có điều khoản nào trong thỏa thuận này được hiểu là ngăn cản bên được cấp phép tham gia vào các hoạt động bên trong hay bên ngoài lãnh thổ, nơi “các hoạt động như vậy sẽ không (1) vi phạm bằng sáng chế và/hoặc bất kỳ quyền sở hữu trí tuệ nào khác; và/hoặc (2) sử dụng hoặc sử dụng sai phương pháp được cấp phép; và/hoặc sử dụng hoặc yêu cầu sử dụng bất kỳ thông tin mật nào của Pfizer”.Tiền bản quyền: giấy phép được miễn phí tiền bản quyền trong trường hợp có tình trạng khẩn cấp y tế công cộng quốc tế (PHEIC) do WHO ban bố. Sau khi PHEIC kết thúc, tiền bản quyền sẽ là 5% doanh thu thuần bán cho các cơ quan chính phủ hoặc các bên mua công và 10% doanh thu thuần bán cho các tổ chức thương mại. Pfizer sẽ không thu tiền bản quyền khi bán cho các quốc gia có thu nhập thấp hoặc bán sản phẩm “được sản xuất và được bán ở các quốc gia trong diện được cấp phép, nơi sản phẩm không được cấp bằng sáng chế và không được hưởng lợi từ tính độc quyền theo quy định”.Vấn đề đảm bảo chất lượng: bên được cấp phép phải có được sự phê chuẩn của chương trình tiền thẩm định thuốc của WHO hoặc một cơ quan quản lý dược nghiêm ngặt (SRA). Nếu chưa có được sự chấp thuận này, có thể xin cấp phép sử dụng tạm thời hoặc khẩn cấp thông qua WHO hoặc SRA.Tính độc quyền của dữ liệu: tính độc quyền của dữ liệu được bỏ qua ở các quốc gia nằm trong diện có hình thức bảo vệ như vậy, từ đó tạo điều kiện phê duyệt theo quy định đối với thuốc generic (thuốc sao chép).Tiết lộ bằng sáng chế: giấy phép tiết lộ cho MPP và bên được cấp phép danh sách các đơn đăng ký bằng sáng chế trên toàn thế giới tại thời điểm ký giấy phép. BÌNH ANThuốc uống tại nhà giúp sớm kiểm soát đại dịchVirus SARS-CoV-2 vẫn đang “tung hoành” và đang có xu hướng tăng trở lại tại một số nơi trên thế giới, trong đó có Việt Nam. Tuy hiệu quả bảo vệ khỏi tử vong hoặc bệnh nặng của các vắc xin ngừa COVID-19 đã được chứng minh nhưng tỉ lệ bao phủ vắc xin ở các nước đang phát triển vẫn còn thấp. Do vậy, việc tìm ra một loại thuốc uống điều trị Covid-19 mới tiện lợi trong sử dụng sẽ giúp kiểm soát đại dịch tốt hơn.Các liệu pháp điều trị COVID-19 hiện có như truyền huyết thanh miễn dịch và các phác đồ điều trị chuyên biệt sử dụng thuốc kháng virus hay kháng viêm đều yêu cầu phải đến cơ sở y tế hay bệnh viện. Vì thế, việc phát triển các thuốc uống điều trị có thể sử dụng tại nhà để giảm tỉ lệ nhập viện hoặc tử vong do bệnh COVID-19 là rất cần thiết trong cuộc chiến chống đại dịch này.Vào đầu tháng 11, Pfizer đã công bố kết quả thử nghiệm lâm sàng pha 2/3 đối với thuốc uống Paxlovid dạng viên nén. Trong vòng 3 ngày kể từ khi khởi phát triệu chứng, nhóm bệnh nhân sử dụng thuốc Paxlovid có tỉ lệ nhập viện hoặc tử vong do Covid-19 giảm 89% so với nhóm sử dụng giả dược.Bằng chứng là trong suốt 28 ngày theo dõi, chỉ có 0,8% bệnh nhân (tức 3 trong số 389 người sử dụng thuốc Paxlovid) nhập viện và không có tử vong. Trong khi đó tỉ lệ này đối với nhóm sử dụng giả dược là 7% với 27/385 người nhập viện và 7 người chết sau đó. Hiệu quả tương tự của thuốc này cũng được ghi nhận trên nhóm bệnh nhân được điều trị trong vòng 5 ngày kể từ khi phát hiện triệu chứng.Với kết quả này, Hãng dược phẩm Pfizer có thể làm thay đổi cục diện trong cuộc chiến toàn cầu nhằm ngăn chặn sự tàn phá khốc liệt của đại dịch. Vì có đến 9 trong số 10 người nhập viện sẽ được loại bỏ khi sử dụng thuốc Paxlovid.Sản xuất thuốc viên điều trị COVID-19 của Pfizer tại Freigburg, Đức trong tháng 11-2021 – Ảnh: PfizerTrước đó vào đầu tháng 10, Công ty Merck công bố thuốc uống Molnupiravir làm giảm 50% tỉ lệ nhập viện hoặc tử vong ở bệnh nhân Covid-19 có triệu chứng nhẹ đến trung bình khi sử dụng trong vòng 5 ngày kể từ khi xuất hiện triệu chứng.Trong thử nghiệm lâm sàng pha 3, họ theo dõi hiệu quả của thuốc trong vòng 29 ngày sau khi uống. Kết quả cho thấy tỉ lệ nhập viện hoặc tử vong của nhóm bệnh nhân điều trị với thuốc Molnupiravir là 7,3% (28/385 người, không có tử vong) so với 14,1% (53/377 người, 8 trường hợp tử vong) ở nhóm sử dụng giả dược. Hiện nay tại Việt Nam, thuốc Molnupiravir cũng được Bộ Y tế đưa vào chương trình thí điểm điều trị COVID-19 tại nhà và cộng đồng, và đang trong giai đoạn thử nghiệm 3.Như vậy, nếu được chấp thuận và cho phép, Paxlovid và Molnupiravir sẽ là 2 thuốc uống điều trị COVID-19 tại nhà tiện lợi thông qua cơ chế ức chế sự nhân lên của virus SARS-CoV-2. Với việc cả 2 công ty Pfizer và Merck đều thông báo sẵn sàng hỗ trợ và chuyển giao công nghệ sản xuất và phân phối thuốc tại các quốc gia đang phát triển (bao gồm cả Việt Nam) có thể sẽ giúp trên 50% dân số thế giới có thể tiếp cận được 2 loại thuốc kháng virus này.Tóm lại, cùng với vắc xin, các thuốc điều trị COVID-19 tại nhà sẽ giúp sớm đẩy lùi đại dịch. Hy vọng Việt Nam sẽ sớm tiếp nhận công nghệ và tự chủ sản xuất các loại thuốc này trong tương lai gần.Tại Việt Nam, tôi biết một số hãng dược lớn trong nước như Công ty CP Dược Hậu Giang hay Công ty CP TRAPHACO đều có năng lực sản xuất thuốc điều trị COVID-19 khi được chuyển giao công nghệ vì công nghệ sản xuất thuốc đơn giản hơn rất nhiều so với sản xuất vắc xin.Tuy nhiên, việc tiếp cận nguồn nguyên liệu thô được cho là thách thức lớn của chúng ta. Do nhu cầu sản xuất thuốc rất cao ở nhiều quốc gia, nên nguồn cung cấp nguyên liệu sản xuất dự báo sẽ thiếu hụt.TS TRẦN MINH TRANG (Đại học Ghent, Bỉ)Được cấp phép, doanh nghiệp Việt đủ năng lực sản xuấtCùng với thông tin từ Pfizer, hy vọng Việt Nam sớm chủ động được thuốc điều trị COVID-19 khi sắp tới có thể sẽ có 3 thuốc điều trị COVID-19 thể nhẹ được cấp phép lưu hành chính thức tại Việt Nam.Với thuốc điều trị của Pfizer, Cục Quản lý dược cho biết từ 2 tháng trước, Bộ Y tế đã có đề xuất về nhu cầu thuốc điều trị COVID-19 gửi Pfizer và nếu được cho phép, Việt Nam cũng sẽ tham gia sản xuất thuốc này.Cần có thuốc điều trịTừ thời điểm nới giãn cách, số ca mắc COVID-19 trong nước đã tăng trở lại và càng ngày càng tiệm cận con số 10.000 ca mắc/ngày, gần bằng giai đoạn cao điểm của dịch. Hiện số ca tử vong cũng đang xấp xỉ 100 ca/ngày.Số mắc và số tử vong này ở thời điểm độ bao phủ vắc xin tăng cao và Việt Nam đang gần đến ngày 100% người từ 18 tuổi trở lên được tiêm ít nhất 1 mũi vắc xin cho thấy vai trò và sự cần thiết của thuốc điều trị: có vắc xin có thể giảm bớt số ca mắc, nhưng khi có nhiều ca mắc phải cần thuốc điều trị.Theo một khảo sát quy mô nhỏ tại Việt Nam, có 97,5% người tiêm vắc xin Pfizer có sinh miễn dịch, tức vẫn còn 2,25% “lọt sổ”, chưa kể nguy cơ nhiễm COVID-19 của những người có sinh miễn dịch nhưng hiệu quả thấp. Điều đó cho thấy sự cần thiết của thuốc điều trị.Nhìn lại đợt dịch thứ tư vừa qua, một trong những nguyên nhân khiến ca tử vong cao là khả năng chống đỡ của hệ thống y tế khi số ca mắc mới tăng liên tục, vượt khả năng kiểm soát tại một số địa phương. Lúc này, nếu có thuốc điều trị có hiệu quả thì cơ hội giảm số tử vong là hoàn toàn có thể.Túi thuốc dành cho bệnh nhân F0 điều trị tại nhà có thuốc kháng virus Molnupiravir – Ảnh: THU HIẾNThuốc điều trị thử nghiệm thời gian qua thế nào?Có một loại thuốc đã được thử nghiệm điều trị có kiểm soát tại các tỉnh thành thời gian qua và bước đầu cho thấy không có ca tử vong trong số người được sử dụng thuốc này là Molnupiravir. Theo đánh giá của Cục Khoa học – công nghệ và đào tạo, Bộ Y tế – đơn vị thực hiện thử nghiệm này, căn cứ kết quả sử dụng thuốc tại Bệnh viện Thống Nhất, Bệnh viện Phổi trung ương về tính an toàn và hiệu quả thuốc, Bộ Y tế đã cho phép triển khai chương trình sử dụng thuốc có kiểm soát Molnupiravir cho các trường hợp mắc COVID-19 thể nhẹ tại nhà và cộng đồng tại TP.HCM từ giữa tháng 8-2021 và hiện nay đã mở rộng triển khai tại 22 tỉnh thành.Các kết quả báo cáo giữa kỳ của chương trình tại 22 địa phương cho thấy thuốc có tính an toàn, dung nạp tốt, hiệu quả rõ rệt về giảm tải lượng virus, giảm lây lan, giảm chuyển nặng, rút ngắn thời gian điều trị, tỉ lệ chuyển nặng rất thấp, từ 0,02-0,06% và không có ca nào dẫn đến tử vong.Một thành viên của nhóm nghiên cứu cho biết tác dụng chính của thuốc này là ngăn chặn sự nhân lên của virus, vì vậy thuốc có tác dụng rõ rệt ở giai đoạn bệnh nhân ở thể nhẹ. “Nhưng khi bệnh đã đến giai đoạn suy hô hấp thì không có tác dụng” – vị này cho biết.Thông tin từ Cục Quản lý dược, Bộ Y tế, song song với quá trình thử nghiệm thuốc, cục và các nhà sản xuất đã chuẩn bị hồ sơ để Vụ Pháp chế, Bộ Y tế xem xét vướng mắc nếu muốn sản xuất và lưu hành rộng rãi hơn. Theo Luật dược, một loại thuốc mới phải được thử nghiệm lâm sàng mới được cấp phép, trong khi Molnupiravir chỉ mới thử nghiệm điều trị và quy mô còn nhỏ. Theo thông tin Tuổi Trẻ có được, hiện đã có 3 nhà sản xuất thuốc này tại Việt Nam và sẵn sàng tham gia cung cấp khi thuốc có visa lưu hành.LAN ANHViệt Nam có năng lực sản xuất nếu có phépTrao đổi với Tuổi Trẻ, PGS.TS Đỗ Văn Dũng – trưởng khoa y tế công cộng Trường ĐH Y dược TP.HCM – cho rằng vấn đề hiện nay của thuốc Molnupiravir là chuyển giao công nghệ (bản quyền), còn nguyên liệu cũng như năng lực sản xuất trong nước đều có thể đáp ứng, đây không phải là vấn đề quá phức tạp. “Thuốc là hóa chất, không phải là protein như vắc xin nên khi sản xuất xong là có thể biết có đạt chất lượng hay không” – ông Dũng nói.Theo tìm hiểu, tại Việt Nam hiện nay Viện Hóa sinh biển (Viện hàn lâm Khoa học và công nghệ Việt Nam) đã nghiên cứu và công bố thành công trong việc tạo ra quy trình tổng hợp và tinh chế hoạt chất Molnupiravir quy mô pilot (quy mô lớn hơn nhiều so với quy mô phòng thí nghiệm, nhưng nhỏ hơn quy mô sản xuất).Mới đây, đơn vị này đã ký kết hợp đồng chuyển giao quy trình sản xuất Molnupiravir quy mô pilot cho một công ty dược phẩm với mong muốn nhanh chóng có thuốc Molnupiravir của Việt Nam.Ngoài ra theo thông tin từ cổng thông tin của Bộ Y tế, đơn vị này còn nghiên cứu các loại thuốc điều trị và đã đạt được những thành công như xây dựng được quy trình tổng hợp thuốc Favipiravir quy mô phòng thí nghiệm; nghiên cứu thành công giai đoạn tiền lâm sàng thuốc thử nghiệm điều trị COVID-19 từ thảo dược…Một công ty dược phẩm nổi tiếng ở Việt Nam cho biết đơn vị đang chạy đua sản xuất một loại thuốc dùng điều trị COVID-19. Thuốc này dạng chích, người mắc COVID-19 chỉ cần tiêm một mũi, thường sau 3-5 ngày sẽ phát huy tác dụng giảm tải lượng virus đáng kể (âm tính), không cho virus xâm nhập vào phổi, các mô, đường ruột và tim mạch. “Thuốc này đã được Bộ Y tế cấp phép thử nghiệm giai đoạn đầu tại một số bệnh viện ở phía Nam và phía Bắc, bước đầu cho thấy hiệu quả, an toàn” – vị này nói.HƯƠNG THẢO
[ad_2]